
发布时间:2019-12-30 来源: 浏览量:249次
2019年,创新药开发依旧火热,国产1类新药IND数量继续超过110个,再创新高;正大天晴8件IND获国家CDE受理,位列所有国内药企之首,紧随其后为石药集团、广东东阳光、江苏恒瑞等;所有IND基本信息及部分品种披露信息见本稿。
1. 2019全年:国产1类新药IND总体情况
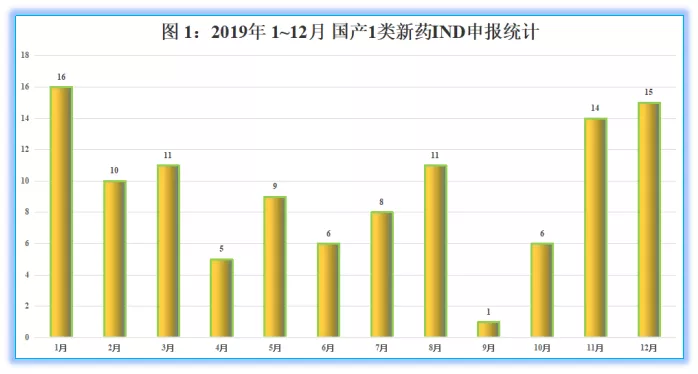
2019全年,国产1类新药(化药)注册申报IND品种>110个(2018年近于100个),创新品种开发形势整体处于增长趋势。
其中,全年注册申报数量最多的月份为1月,共16个品种进入IND阶段,最少的月份为9月,国产1类新药IND仅1个品种(PS:为体现国产1类新药创新水品,外国企业注册申报的进口IND不列入统计之内)。
2. 2019全年:国产1类新药IND企业分析
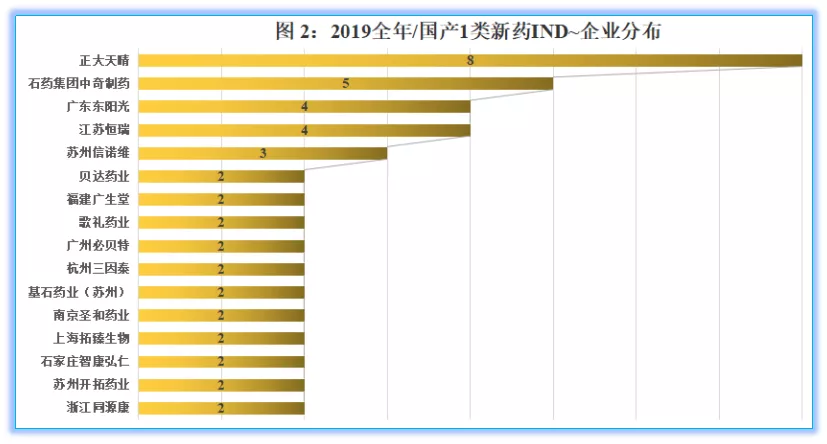
企业方面,IND申报数量相对较多的为正大天晴,共8件,品种分别为TQB3562片、TQA3563片、TQB3804片、TQC3564片、TQB3303片、TQB3602胶囊、TQB3473片、TQB3728片;天晴对于IND申报品种所对外披露的信息相对不多,这些品种的具体方向和特点需要进一步等待公司披露。
紧随正大天晴之后的为石药集团中奇制药(5件)、广东东阳光(4件)、江苏恒瑞(4件)、苏州信诺维(3件);IND品种数量为2个的企业还有浙江同源康、苏州开拓药业、石家庄智康弘仁、上海拓臻生物、南京圣和药业、基石药业(苏州)、杭州三因泰、广州必贝特、歌礼药业、福建广生堂、贝达药业。
3. 2019全年:国内部分IND品种分析
新药IND阶段的品种,由于种种原因,披露的信息往往不多,通过查询,部分IND品种信息如下,排列顺序为时间倒序。
CS3002
由基石药业开发,为CDK4/6选择性抑制剂,通过特异性抑制CDK4/6激酶的活性,达到抑制肿瘤生长的目的。临床前研究表明,CS3002具有与palbociclib相当的体内外活性,在小鼠动物模型中,联合PD-1单抗或内分泌治疗均显示出了良好的抑制肿瘤生长的作用,且联合治疗优于单药治疗;在安全性及耐受性上也显示出潜在优势。
PS:已收到澳大利亚人类研究伦理委员会签发的临床试验伦理许可。
ABSK011
由上海和誉生物医药科技有限公司开发,为公司独立自主研发的小分子口服FGFR4抑制剂,其优良的活性、选择性及其它理化特性预示着该药物具有成为全球best-in-class潜力,该药物的临床开发将进一步拓宽和誉医药在肿瘤治疗领域的布局。
PS:已获得台湾食品药品监督管理局临床试验许可,即将开展针对肝细胞癌的临床1期研究。
GST-HG131
由福建广生堂药业股份有限公司开发,是拥有全球知识产权的乙肝治疗全球创新药,属First-in-Class全球领先项目,有机会成为全球首个上市的乙肝HBsAg抑制剂创新药,是公司乙肝功能性治愈“登峰计划”重要组合方案之一。GST-HG131核心化合物已申请PCT国际专利,其中国专利已获得授权通知书。
BPI-27336
由贝达药业自主研发的拥有完全自主知识产权的新分子实体化合物,是一种新型强效、选择性的细胞外调节激酶1/2(ERK1/2)口服小分子抑制剂,拟用于RAS/RAF/MEK激活变异的结直肠癌、胰腺癌、肺癌、肝癌、胃癌、黑色素瘤等实体瘤的治疗。截至公告披露日,全球范围内尚无ERK1/2抑制剂上市,国外有若干ERK1/2抑制剂处于临床研究阶段。
HH2710
由上海海和药物与中国科学院上海药物研究所合作开发,是一种高效、特异性的小分子ERK激酶抑制剂。早期的非临床研究结果显示,HH2710的体外抗肿瘤活性、药代动力学特性及安全性表现俱佳;在CDX模型中,HH2710的体内抗肿瘤活性明显优于相同剂量下的同类化合物。且2019年09月,已获得美国FDA的临床试验许可,拟用于治疗经检测确认存在MAPK信号通路基因异常的恶性肿瘤。
KC1036
KC1036是康辰药业自主研发的境内外均未上市的化学药品1类创新药,拟用于实体肿瘤和血液肿瘤的治疗。属多靶点酪氨酸激酶抑制剂,临床前研究结果显示,KC1036激酶活性强,在多种实体肿瘤和血液肿瘤的动物模型中均表现出显著抑瘤活性,且安全性较好。康辰药业称,截至公告日,公司在KC1036项目上投入的研发费用约2277万元。
ORIN1001
ORIN1001是复星医药子公司“复星弘创”自主研发的具有新酶型靶点、新作用机制和新化学结构类型的首创(First-in-Class)小分子药物,用于治疗晚期实体瘤,其第一个探索中的适应症为复发性、难治性、转移性乳腺癌。截至2019年5月,复星医药集团针对该新药已累计投入为约4547万元用于研发。且美国FDA已授予其新药ORIN1001用于治疗复发性、难治性、转移性乳腺癌(包括三阴乳腺癌)的快速通道资格(Fast Track designation)。
FCN-647
复星医药控股子公司重庆复创医药研究有限公司开发,用于治疗复发或难治的B淋巴细胞恶性肿瘤,截至2019年9月,该集团现阶段针对该新药累计研发投入为人民币约2368万元(未经审计)。根据IQVIA数据,与该新药同靶点的药品在全球的销售额约为45.1亿美元。
HSK21542
由海思科开发,为全新具有自主知识产权的镇痛药物,拟用于急慢性疼痛的治疗,注册分类为化药1类。据临床前研究,HSK21542为外周kappa阿片受体的选择性激动剂,具有强效且长效的镇痛作用,不易透过血脑屏障,在发挥外周镇痛的同时,能避免中枢阿片类药物相关副作用,如成瘾、致幻、呼吸抑制等。这些特点表明HSK21542具有药效显著、安全性良好等明显临床优势,可为众多的急慢性疼痛患者提供更优的用药选择。截至目前,公司在HSK21542注射液的研发投入约2,000万元。
SH2442
由南京圣和药业股份有限公司自主开发,是一款乙酰辅酶A羧化酶的小分子抑制剂,为国内首家申报的该靶点创新药,用于治疗非酒精性脂肪性肝炎(NASH)及其引起的肝纤维化,拥有贝诺司他化合物、合成工艺、制剂、用途的全球知识产权。
TY-302
由郑州泰基鸿诺医药股份有限公司开发,拥有完全自主知识产权,是一种强效、高选择性的口服细胞周期蛋白依赖性激酶4/6(CDK4/6)抑制剂,用于激素受体阳性和表皮生长因子受体2阴性(HR+/HER2-)局部晚期或转移性乳腺癌等晚期实体瘤或血液系统肿瘤的治疗。2019年10月份以来,由该公司自主研发的抗肺癌新药和抗乳腺癌药物两个国家1.1类新药项目相继获得临床试验批准。
GST-HG141
福建广生堂药业股份有限公司历经四年完成了GST-HG141申请临床试验所需的全部数据和全套资料,于2019年8月收到国家药品监督管理局下发的《受理通知书》,公司乙肝治疗全球创新药乙肝核心蛋白抑制剂GST-HG141临床申请获得受理,申请阶段“临床”。该项目是广生堂在众多基础研究科学家指导下提出的乙肝功能性治愈“登峰计划”的最重要组成药物之一,是与具备领先新药研发实力的上海药明康德新药开发有限公司合作研发的成果,目前全球尚无该靶点药物上市,有望成为Best-in-class项目。目标:挑战乙肝功能性治愈。GST-HG141核心化合物已申请PCT国际专利,计划进入中国、美国、日本、欧洲等24个国家和地区。
HTD1801
HTD1801,由深圳君圣泰生物开发,FDA已授予其研究性小分子创新药HTD1801治疗非酒精性脂肪性肝炎(NASH)的快速通道审评资格认定。之前,FDA还授予了HTD1801治疗原发性硬化性胆管炎(PSC)的孤儿药资格认定和快速通道审评资格认定。目前,HTD1801治疗PSC的II期临床试验正在美国开展,治疗NASH的II期研究计划很快在美国启动患者招募。
TY-9591
同源康医药首个进入临床试验的国家1类抗肿瘤靶向新药,第三代表皮生长因子受体(EGFR)抑制剂,对标奥希替尼,其化合物发明专利已获授权。
DN1508052-01
上海迪诺医药开发,一种高效的小分子TLR8激动剂(国内提交IND的首个TLR8激动剂),拟用于癌症的免疫治疗。2018年11月,上海迪诺医药收到FDA已完成DN1508052-01新药临床研究申请(IND)审核的信函。2019年5月下旬,上海迪诺医药启动了一项开放、多中心的Ⅰ期临床试验,拟招募25名受试者,旨在初步评价DN1508052-01单药经皮下注射用于实体瘤患者的安全耐受、药物代谢动力学特性及抗肿瘤活性。
JAB-3312
JAB-3312可以阻断KRAS-MAPK信号通路,用于治疗非小细胞肺癌、结直肠癌、胰腺癌等实体瘤,同时也可以解除肿瘤免疫抑制微环境,增强现有肿瘤免疫疗法的功效。2019年7月3日,加科思自主开发的小分子口服JAB-3312获得美国FDA新药临床试验许可,这是继JAB-3068进入临床IIa期之后,公司第二个进入临床的小分子抗癌药。
富马酸奥比特嗪
富马酸奥比特嗪,由中南大学和深圳市真兴医药技术有限公司合作开发,能特异性激活肿瘤细胞凋亡信号转导通路关键酶原~半胱天冬蛋白酶-3酶原,将其活化为肿瘤凋亡关键执行分子半胱天冬酶-3,而导致肿瘤细胞快速死亡。临床适应症主要为非小细胞肺癌。
TERN-201
TERN-201,最初由礼来(Eli Lilly)研发。2018年,拓臻生物与礼来签订开发、制造和商业化TERN-201治疗NASH的全球独家协议。在2019上半年于维也纳举行的国际肝脏大会上,拓臻生物发表了TERN-201临床前研究数据,显示其在NASH啮齿类动物模型中显著改善肝脏NAS评分和纤维化。拓臻生物最近自GENFIT获得在大中华区开发、制造和商业化PPAR α/δ 双重激动剂Elafibranor用于治疗非酒精性脂肪性肝炎(NASH)和原发性胆汁性胆管炎(PBC)的专有权。Elafibranor前期临床试验结果显示针对NASH和PBC两种适应症的正面结果,并有可能成为未来联合用药疗法的重要组成部分。
AST-3424
AST-3424是艾欣达伟和台湾浩鼎联合研发的一款以过表达AKR1C3为标靶的first-in-class抗癌药。AST-3424在AKR1C3作用下,会选择性地释出强效DNA烷基化剂,启动歼灭癌细胞机制;这种选择性启动机制,使得AKR1C3在多种抗药性及难治癌症,如肝癌,去势抵挡性前列腺癌,T细胞急性淋巴性白血病等肿瘤细胞中,均有高度表现。台湾浩鼎正在美国进行治疗实体瘤的临床I/II期研究。2018年7月,OBI-3424获得FDA孤儿药资格。2019年4月,NMPA受理本品的临床试验申请。
TSL-0319
TSL-0319胶囊是天士力自主研发的二肽基肽酶4(DPP-4)抑制剂,通过抑制胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP)的灭活,促进胰岛释放胰岛素,从而提高胰岛素水平,达到降低血糖的目的。该药属于1类化学药,拥有完全自主知识产权,属于境内外均未上市的创新药。该项目目前已投入研发费用约1694.65万元。
注射用LH021
LH021具有潜在的修复膝关节受损软骨的特点,属于改善病情药物。
2015~2016年,完成了机制研究;
2016年5月,正式立项;6月,启动药学CMC;12月,申请国内专利;
2017年6月,启动安评研究;
2018年9月,IND package正式完成;10月召开pre-IND meeting;
2019年1月,正式提交IND;3月正式受理。临床试验方案设计的思路将主要借鉴国外DMOAD类药物临床研究的经验。
参考国内外同类产品的临床试验经验,LH021首次人体I期临床试验的受试者人群将选择符合入选标准的原发性膝骨关节炎患者,而不选择健康受试者。I期临床试验除了考察LH021剂量爬升过程的耐受性和药代特点,同时也将探索LH021的剂量跟疗效以及软骨合成和代谢相关生物标记物的关系,为II期临床试验给药方案的制定提供依据。
首次人体临床试验采用单次联合多次剂量递增给药用于治疗原发性膝关节骨关节炎。单次给药后观察28天,多次给药一周期后随访28天,试验周期共计11周。
TTP273
TTP273,是vTv公司利用其小分子药物研发平台发现的非肽类、高选择性胰高血糖素样肽-1受体(GLP-1r)激动剂,为vTv公司全球首创(first-in-class),目前在美国已完成IIb期临床研究,结果显示TTP273对降低糖尿病患者的糖化血红蛋白效果明显,且耐受性良好。TTP273项目最大的特色和亮点在于目前上市的GLP-1及其类似物,均为注射剂型,而TTP273产品为首创的小分子非肽类口服剂型。中美华东本次通过授权许可形式引入TTP273项目,并作为公司在GLP-1类糖尿病产品线的补充,与公司现有在研的利拉鲁肽注射液形成优势互补。
101BHG-D01
101BHG-D01,为北京硕佰医药科技有限责任公司开发的用于治疗哮喘/慢阻肺的1类新药。北京硕佰医药科技有限责任公司,于2016年在北京市丰硕维康技术开发有限责任公司(2001年成立)和北京嘉事联博医药科技有限公司(2007年成立)基础上,经融资重组而设立。公司共有研发团队40人,核心团队具有30多年的新药研发经验,分设药学部、临床医学部、行政人事部、知识产权部等部门,主要经营业务是创新药物研发。
LH021
LH021,为广州领晟医疗科技有限公司自主研发的用于治疗骨关节炎的1类新药。广州领晟医疗科技有限公司成立于2012年,从事新靶点创新药物研发,公司由海外留学人员和国内医药行业精英创立,目前公司的研发管线中已有12个新药项目,覆盖肿瘤、消化科等重大的慢性疾病领域以及老龄化相关的专科疾病。
GST-HG151
GST-HG151,为福建广生堂药业股份有限公司与上海药明康德新药开发有限公司合作研发的非酒精性脂肪肝病及肝纤维化可逆转药物。临床前研究展示了改善肝功能 的作用和显著的抗纤维化效果,有望填补全球抗肝纤维化领域的空白,攻克肝纤维化、肝硬化不可逆转的世界性难题。
LX-039
LX-039,为山东罗欣药业集团股份有限公司开发的乳腺癌领域1类新药,该药物是新型的、口服有效的选择性雌激素受体下调剂,将主要用于晚期乳腺癌的治疗。目前,国内外尚无该机理口服药物上市,同类产品处于临床I/II期。
YPS345
YPS345,为天方药业有限公司与中国科学院生物物理研究所共同开发的拟用于肿瘤患者胸部放射治疗引起的肺炎、肺纤维化治疗的1类新药,目前市场尚无相同产品。天方药业在开展YPS345非临床试验研究阶段,经有效性及安全性研究结果表明,作为预防和治疗放射性炎症的药物,其对动物模型上放化疗诱导的肺纤维化均有显著的缓解作用,且安全性好。
CS3003
CS3003,为基石药业开发的HDAC6选择性抑制剂,可作为单药治疗也可与常规标准疗法联用,有在多发性骨髓瘤中展示更好的疗效的潜力。临床前研究数据以及同类产品的临床前和早期临床研究还发现,CS3003较广谱HDAC抑制剂可能具备更好的安全性,以及有在不同的适应症中开发与免疫检查点抑制剂联合治疗的潜力。
ASC21
ASC21,由歌礼制药开发,是一种与NS5B聚合酶结合的核苷酸抑制剂,通过抑制NS5B聚合酶的活性从而阻止慢性丙肝病毒感染。临床前研究表明,ASC21是一种有效的泛基因型药物,耐药基因屏障高。歌礼计划将其与拉维达韦联用,用于治疗难治型、肝硬化及HCV/HIV共感染的患者。
附表:2019全年国内1类新药IND数据
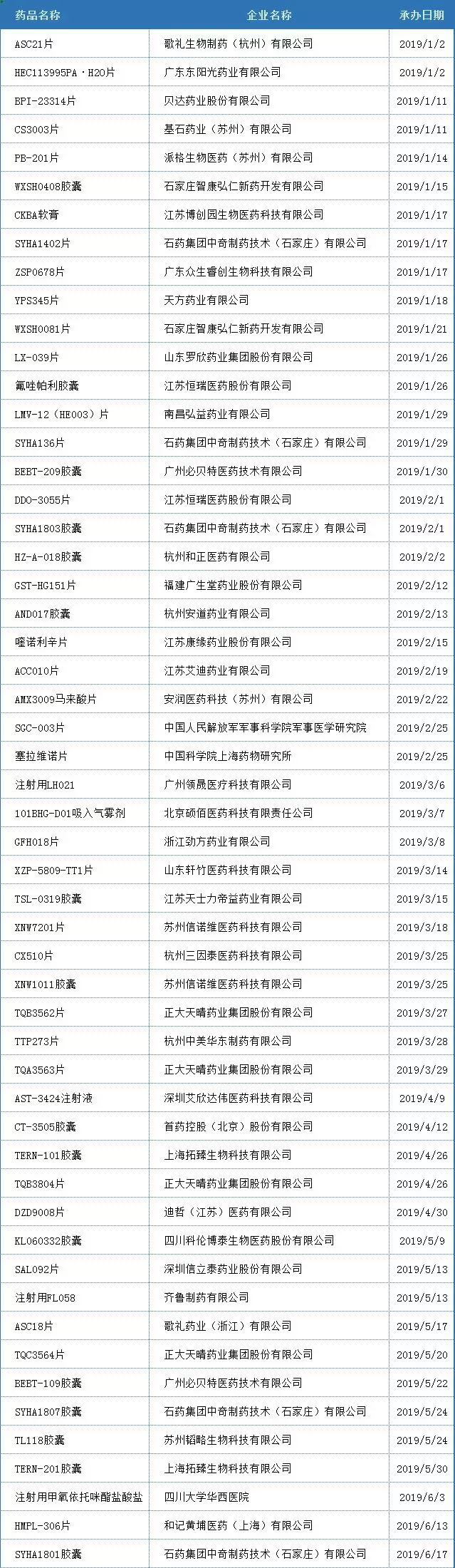
(以品种首次承办日期统计,国外企业不列入统计范围;统计时间2019.12.26)
数据来源:药智数据、受理公告、雪球、搜狐医药、新浪医药、各大公司官网(及《受理通知书》公告)、证券公司官网。